INTRODUÇÃO
O hexanal é um dos muitos componentes aromáticos bem documentados que contribuem para o sabor e aroma em produtos alimentícios de consumo comum contendo ácidos graxos ômega-6. O conteúdo de hexanal também é usado para medir o estado oxidativo de alimentos ricos em ácidos graxos ômega-6.
A amostragem dinâmica de headspace difere da amostragem estática de headspace, pois o headspace acima da amostra é varrido com um gás para uma armadilha adsorvente, em vez de permitir que uma amostra e seu headspace atinjam um equilíbrio estático antes de transferir os compostos voláteis para um cromatógrafo a gás/espectrômetro de massa (GC/MS). O emprego de amostragem dinâmica de headspace fornece todos os benefícios do headspace estático com recursos de detecção de baixo nível semelhantes à análise por purge e trap.
O conteúdo de hexanal de dois produtos alimentícios de consumo comum, arroz e fórmula infantil, foi avaliado quanto ao conteúdo de hexanal. O headspace dinâmico foi usado para concentrar o hexanal de produtos alimentícios, minimizando a extração e limpeza de solventes que exigem muita mão de obra. O hexanal foi então separado de outros compostos voláteis e quantificado com GC/MS.



Figura 1. Amostrador Headspace SCION HT3 junto com a plataforma SCION Instruments 8300 GC em combinação com até 8700 SQ-MS.
Os ácidos graxos ômega-6 são os ácidos graxos mais comumente encontrados nos alimentos que comemos. O hexanal é formado quando esses ácidos graxos ômega-6 são oxidados. O hexanal é um componente aromático que contribui para o sabor e aroma em produtos alimentícios de consumo comum contendo ácidos graxos. O conteúdo de hexanal pode ser usado para medir a qualidade do sabor e aroma de alimentos ricos em ácidos graxos, bem como seu estado oxidativo.
Arroz e fórmula infantil, ácidos graxos contendo produtos alimentícios de consumo, foram avaliados para hexanal usando a opção dinâmica do Analisador Estático e Dinâmico de Headspace SCION Instruments HT3. A opção dinâmica melhora a sensibilidade em relação ao método estático varrendo e concentrando continuamente os analitos em uma armadilha adsorvente, resultando em um aumento de 10 a 100 vezes na sensibilidade, dependendo do composto.
Ao medir o conteúdo de hexanal como um marcador oxidativo de lipídios, a correspondência de matriz é crítica devido aos efeitos de diferentes concentrações de lipídios na recuperação de hexanal. Elisia 1 e García-Llatas 2 usaram o casamento de matrizes para calcular a precisão de seu método para monitorar a oxidação lipídica durante o armazenamento do leite humano e fórmula infantil. Wang 3 usou arroz sem hexanal para sua curva de calibração para realizar uma correspondência de matriz semelhante.
PREPARAÇÃO PADRÃO E AMOSTRA
Os padrões hexanais foram preparados a 2, 10, 20, 100 e 200 ng/µL em metanol. As curvas de calibração foram criadas de 10 ng a 1000 ng em frascos de headspace de 22 mL adicionando 5 µL de cada padrão de estoque a frascos padrão ou frascos de amostra.
O arroz branco foi obtido localmente. O arroz foi levemente moído em moinho de laboratório. A amostra de arroz consiste em 1 g de arroz moído tanto para a curva de calibração quanto para as amostras. Os padrões e amostras de arroz foram avaliados com headspace dinâmico a 30 °C. Sete amostras de arroz foram preparadas para determinar a reprodutibilidade e precisão.
Três conjuntos de amostras de arroz foram testados para avaliar os voláteis liberados durante o cozimento pela adição de água. O primeiro conjunto foi o arroz seco. O segundo conjunto continha 100 µL de água adicional ou 10% (v/p) de água. O conjunto final continha 500 µL de água adicional ou 50% (v/p) de água.
A fórmula infantil foi obtida localmente. A fórmula infantil consiste em 1 mL tanto para a curva de calibração quanto para as amostras. Os padrões e amostras de fórmula infantil foram avaliados com headspace dinâmico a 37 °C. Sete amostras de fórmula infantil foram preparadas para determinar a reprodutibilidade e precisão.
Tabela 1. Condições de operação da instrumentação
| Parâmetro | Especificação |
|---|---|
| Injetor | Divisão 30:1, 200°C |
| Coluna | Rtx – 502.2 |
| Sobre o programa | 40°C (2 min), 7°C/min a 120°C, 15°C/min a 240°C (7 min) |
| Operadora | Hélio |
| Fluxo | 1,0 ml/min |
| Programas | MSWS/HT3 Teklink |
| Temperatura da linha de transferência MS | 240°C |
| Fonte de íons | 230°C |
| Modo de ionização | EI |
| Início da digitalização | 1,0 |
| Modo de digitalização | Verificação completa |
| HT3 | |
| Temperatura do forno | 150°C |
| Temperatura da linha de transferência | 160°C |
| Temperatura da amostra | 37°C |
| Equilíbrio da amostra | 10 minutos |
RESULTADOS DA CALIBRAÇÃO
As curvas hexanais de 10 ng a 1000 ng de arroz padrão e enriquecido incluindo o coeficiente de correlação (r 2 ) são mostradas na Figura 2. A curva hexanal padrão de 10 ng a 1000 ng em água e fórmula infantil incluindo o coeficiente de correlação (r 2 ) são mostrados na Figura 3. A diferença entre as inclinações das linhas confirma que a correspondência de matriz deve ser realizada ao testar o hexanal em amostras de arroz ou fórmula infantil.
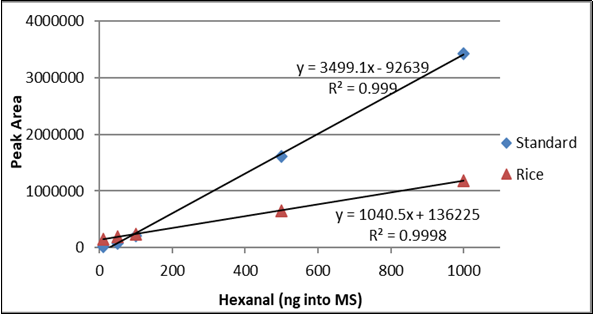
Figura 2. Comparação da curva de calibração hexanal de 10 ng a 1000 ng (losango azul) e em arroz (triângulo vermelho).
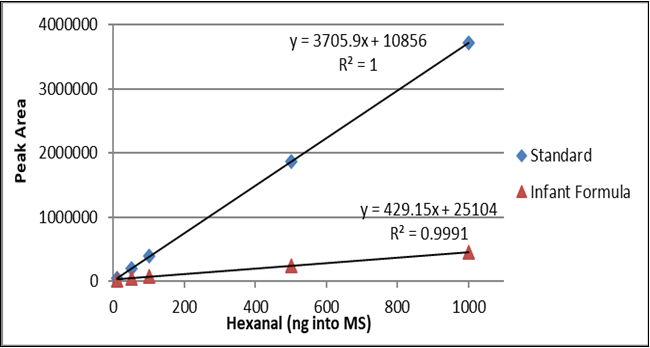
Figura 3. Comparação da curva de calibração hexanal de 10 ng a 1000 ng em água (losango azul) e em fórmula infantil (triângulo vermelho).
Tabela 2. Concentração de Hexanal para sete amostras
| Concentração Hexanal | ||
|---|---|---|
| Amostra | Arroz (ng/g) | (Fórmula ng/ml) |
| 1 | 89,3 | 41,8 |
| 2 | 82,8 | 48,6 |
| 3 | 88,4 | 42,8 |
| 4 | 88,1 | 39,3 |
| 5 | 107,4 | 44,5 |
| 6 | 83,5 | 47,1 |
| 7 | 94,3 | 43,8 |
| %RSD | 9.2 | 7.2 |
| Média | 90,5 | 44,0 |
REPRODUTIBILIDADE E RESULTADOS DE PRECISÃO
A concentração de hexanal foi calculada como ng/mL para as 7 amostras de fórmula infantil usando o fator de resposta dos dados de calibração. A concentração de hexanal foi calculada como ng/g para as 7 amostras de arroz não enriquecido usando o fator de resposta dos dados de calibração usando arroz como matriz de enriquecimento. O íon fragmento 56 m/z foi usado para o cálculo. A Tabela 3 mostra os dados para as sete amostras juntamente com o %RSD e a média.
A Figura 4 é a comparação do cromatograma de íons de massa de 56 m/z de um padrão hexanal de 10 ng em água com uma amostra de fórmula infantil não enriquecida.
A Figura 5 é a comparação do cromatograma de íons de massa de 56 m/z de um padrão hexanal de 50 ng com uma amostra de arroz não enriquecido.

Figura 4. Comparação do Cromatograma de Íons de Massa de 56 m/z de um Padrão Hexanal de 10 ng em Água com uma Amostra de Fórmula Infantil Não Enriquecida.
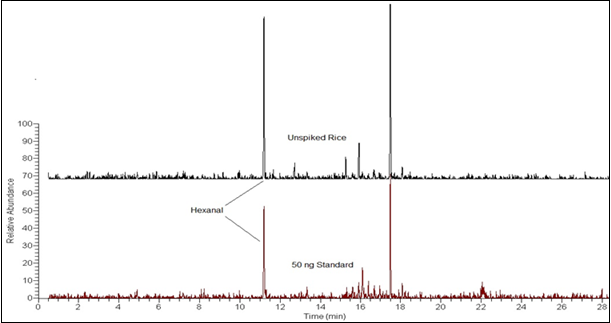
Figura 5. Comparação do Cromatograma de Íons de Massa de 56 m/z de um Padrão Hexanal de 50 ng em Água com uma Amostra de Arroz Não Enriquecido.
RESULTADOS DA ADIÇÃO DE ÁGUA DE ARROZ
A adição de água às amostras de arroz para avaliar outros voláteis liberados durante o cozimento produziu resultados inesperados com os parâmetros dinâmicos de headspace especificados. A primeira foi o aparecimento de outros compostos voláteis que não foram detectados no arroz seco.
A segunda foi a redução do hexanal com o aumento do teor de água, incluindo o padrão hexanal adicionado. A Figura 6 compara o cromatograma iônico total (TIC) do arroz seco e arroz com 10% (100 µL) e 50% (500 µL) de água adicionada, todos com 1000 ng de hexanal adicionados.
Essa redução do pico hexanal também é evidente nas curvas de calibração. A Figura 7 compara a curva de calibração para o arroz seco e os 10% de água adicionada. As amostras de 50% de água/arroz não tinham pico hexanal detectável e nenhuma curva de calibração foi calculada.
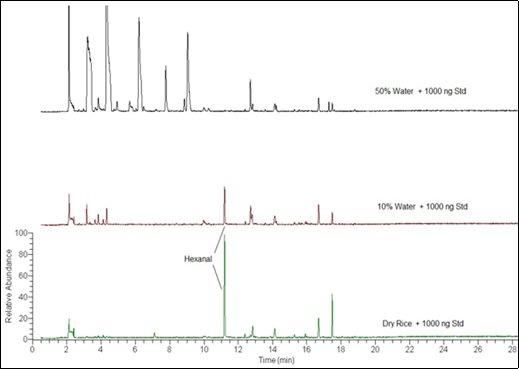
Figura 6. Comparação do TIC para arroz seco e arroz com 10% e 50% de água adicionada.
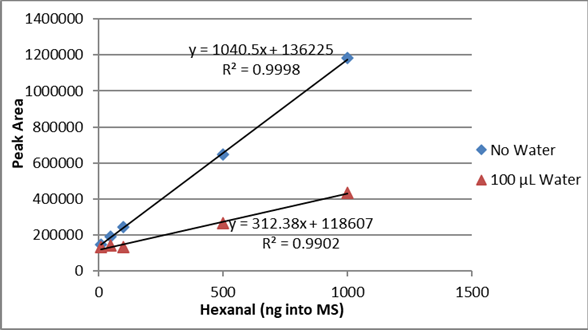
Figura 7. Comparação da curva de calibração hexanal de 10 ng a 1000 ng para arroz enriquecido sem água (losango azul) e arroz enriquecido com 100 µL de água (triângulo vermelho).
CONCLUSÃO
O hexanal foi prontamente determinado com análise dinâmica do headspace em arroz seco e fórmula infantil usando os parâmetros nesta avaliação. As curvas de calibração devem usar correspondência de matriz para fornecer dados precisos.
A adição de água ao arroz seco aumentou a liberação de outros compostos voláteis. Mas também resulta na redução do hexanal, dependendo da quantidade de água adicionada. O mecanismo dessa perda não foi avaliado para este pôster.
REFERÊNCIAS
1 –Elisia I, Kitts DD, Quantificação de hexanal como índice de oxidação lipídica no leite humano e associação com componentes antioxidantes, Journal of Clinical Biochemistry and Nutrition, Volume 49, Issue 3, 2011, pg 147-152
2 – García_Llatas G, Lagarda MJ, Romero F, Abellán P, Farré R, Um método de microextração em fase sólida headspace para uso no monitoramento de hexanal e pentano durante o armazenamento: Aplicação em alimentos infantis líquidos e fórmulas infantis em pó, Food Chemistry, Volume 101 , Edição 3, 2007, página 1078-1086, do endereço da Organização das Nações Unidas para Agricultura e Alimentação:
http://agris.fao.org/agris-search/search.do?recordID=US201301124132
3 – Yiru Wang, Jaeho Ha, Determinação de Hexanal em Arroz Usando um Amostrador de Headspace Dinâmico Automatizado Acoplado a um Espectrômetro de Massa de Cromatógrafo a Gás, Journal of Chromatographic Science, 2012: 00:1-7
